摘要
近幾十年中,高級氧化技術具有反應速度快、處理效率高、適用范圍廣、無二次污染等優點,常被廣泛用于去除水體中的新興有機污染物。但水體中含有溴離子時,基于臭氧或過硫酸鹽氧化過程會產生具有致癌作用的溴酸鹽。文中闡述了臭氧氧化、臭氧/H2O2、催化臭氧氧化、UV/臭氧、UV/TiO2、過硫酸鹽法等基于羥基自由基(·OH)或硫酸根自由基(SO4·-)的高級氧化技術在產生與控制溴酸鹽方面的作用機理及應用現狀,提出了高級氧化過程中控制溴酸鹽生成這一領域未來的研究方向及需要解決的問題。
研究亮點
1、綜述了基于羥基自由基(·OH)或硫酸根自由基(SO4·-)的高級氧化技術在產生與控制溴酸鹽方面的作用機理及應用現狀;
2、提出高級氧化過程中控制溴酸鹽生成這一領域未來的研究方向;
3、提出高級氧化過程中控制溴酸鹽生成需要解決的問題。
傳統水處理工藝主要以除濁殺菌為主,對近年來水體中的一些微污染物如藥品、個人護理產品(PPCPs)和內分泌干擾物(EDCs)等去除能力有限,如何有效去除難降解有機物已經成為水處理的熱點問題。而高級氧化技術(AOPs)為解決傳統工藝處理效果不佳的問題提供了新的方法,其定義由Glaze等首先提出,即以反應中產生的羥基自由基(·OH)為主要氧化劑,氧化分解和礦化水中有機污染物的方法。目前,研究較多的AOPs主要有Fenton氧化法、臭氧類氧化法、過硫酸鹽法、光催化氧化法、超聲氧化法等。
AOPs雖然可以有效降解有機污染物,但氧化過程中產生的副產物限制了其應用。其中,溴酸鹽引起了強烈關注,《飲用水水質準則》第4版和美國環保署的《安全飲用水法》將其列為2B級的潛在致癌物,在飲用水中最高允許含量為10μg/L。研究還發現溴酸鹽和有機鹵代消毒副產物之間的協同作用增加了含溴水的毒性。
溴酸鹽通常在臭氧氧化工藝中形成,而近來的研究表明,在不涉及臭氧的工藝中,如氯化反應、過硫酸鹽氧化和高鐵酸鹽氧化過程,也已檢測到溴酸鹽的生成。溴酸鹽的生成阻礙了這些AOPs在飲用水處理領域的應用,國內外學者對溴酸鹽的產生、控制和去除方面展開了詳細研究。本文對臭氧氧化、臭氧/H2O2、催化臭氧氧化、UV/臭氧、UV/TiO2、過硫酸鹽法等基于·OH或SO4·-的AOPs在生成與控制溴酸鹽方面的研究進展作了介紹,并對其在今后水處理領域研究控制或去除溴酸鹽的發展方向進行展望。
01基于·OH的AOPs
·OH具有活性極高、氧化能力極強的特點,其氧化還原電位E0高達2.80 V,與有機物反應主要通過脫氫、親電子加成及電子轉移等途徑,反應速率為108~1010 mol/(L·s),且無選擇性。以·OH為基礎的AOPs,包括臭氧/催化劑、臭氧/H2O2和UV/H2O2等聯用技術,已被開發用于微污染物的氧化及溴酸鹽的控制。
1.1臭氧氧化法
針對水污染現狀及常規工藝處理效果,臭氧技術被廣泛應用于水的氧化、消毒或兩者的組合,緩解因味道、氣味和有機物引起的水質問題。臭氧氧化能力極強,其標準氧化還原電位為2.07 V。臭氧溶于水后易被誘導分解產生·OH,間接氧化有機物,臭氧在水中分解產生·OH的速率直接影響臭氧氧化反應的效果。楊陽等通過某水廠深度處理中試試驗研究了臭氧對DBPs前體物的去除,優化臭氧投加量即預臭氧、主臭氧投加量分別為1.1、2 mg/L時,組合工藝對總三鹵甲烷前體物和總鹵乙酸前體物去除率高達78.1%和52.4%。
但臭氧應用于處理Br-含量高于50μg/L的水體時,可能引起生成過量溴酸鹽的問題。在臭氧體系氧化含溴水體過程中,溴酸鹽形成的機理已經被系統地研究及修訂。這是一個多步反應的過程,Br-通過臭氧直接氧化途徑和·OH間接氧化途徑形成溴酸鹽,其中,間接氧化途徑又可分為直接-間接氧化途徑和間接-直接氧化途徑,如圖1所示。
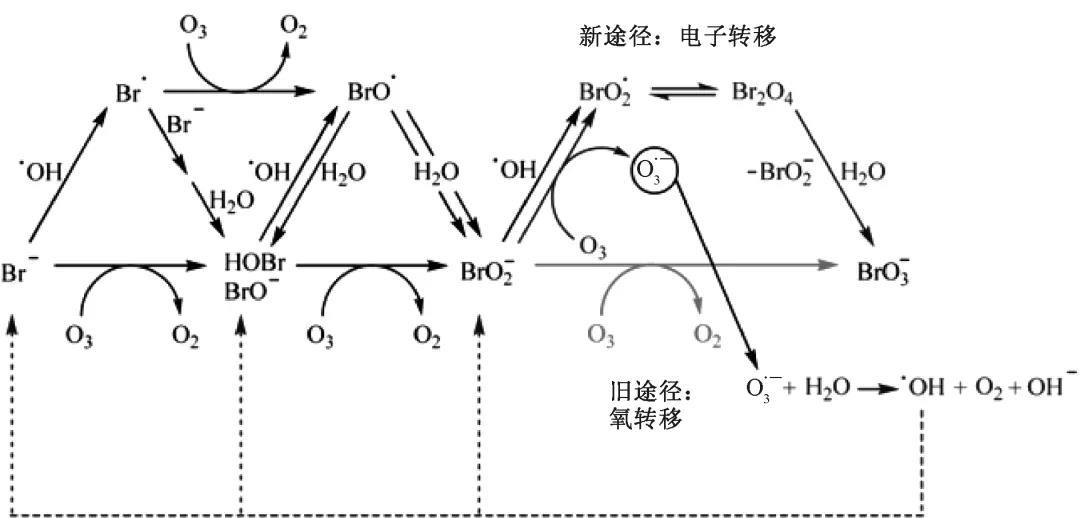
BrO3-的形成過程易受原水的水質條件即水溫、pH、Br-濃度、堿度、有機物濃度,以及臭氧投加量等因素的影響。Antoniou等通過降低pH、加H2O2、加NH4+加Cl2/NH4+等抑制了BrO3-的生成。值得注意的是,實際水處理中應考慮降低pH的適用性與經濟性,以及加NH4+會生成含氮消毒副產物的情況。
除了從生成過程控制BrO3-也可后續設置去除已生成溴酸鹽的工藝。研究表明,活性炭能將BrO3-吸附還原為Br-以去除BrO3-且活性炭常作為臭氧化工藝必備的聯用工藝,易實現生產應用,不需要增加額外的投資。
1.2臭氧/H2O2
H2O2氧化技術具有操作簡單、不產生二次污染的特點,可以獨立進行,也可以作為其他處理方法的預處理或后處理工藝。而臭氧與H2O2聯合使用主要利用兩者的催化作用產生大量自由基,達到降解難溶性有機物的目的。
臭氧/H2O2處理含溴水過程中,H2O2一方面可以加速臭氧分解為·OH,促進Br-向溴酸鹽轉化,另一方面能降低水中臭氧CT值而抑制溴酸鹽。另外,過量的H2O2也可與·OH反應,消耗·OH減少溴酸鹽生成量,并能通過一種副反應將OBr-還原成Br-,從而阻止其進一步氧化成BrO3-。Urs等在臭氧質量濃度為2 mg/L、Br-摩爾濃度恒為0.1 mmol/L條件下,增加H2O2摩爾濃度(0.02~0.5 mmol/L),BrO3-的濃度先增加而后緩慢降低。楊宏偉等以山東省某水廠濾池出水為研究對象,發現臭氧/H2O2技術明顯抑制BrO3-的生成,并確定了控制溴酸鹽的最佳H2O2/臭氧摩爾比為1.5,且在此條件下CODMn及UV254去除效果最好,UV254去除率達57%。王永京等通過中試試驗研究了投加H2O2對臭氧氧化某含溴原水生成溴酸鹽的影響,結果表明,在臭氧消耗量為2.2 mg/L時,增加H2O2/臭氧(質量比為0~1.5),溴酸鹽生成量逐漸降低,且在兩種不同水質條件下,H2O2/臭氧分別為0.2和1.0時可將溴酸鹽質量濃度控制在10μg/L以內。
臭氧/H2O2對溴酸鹽的控制過程較為復雜,其綜合結果取決于氧化過程的pH、H2O2濃度及水質條件等因素。而水廠深度處理工藝中常采用臭氧作為氧化劑,當溴酸鹽濃度未達水質標準要求時,可投加H2O2與臭氧聯用作為處理含溴有機微污染水體的優選工藝,并針對水廠水質進行試驗確定H2O2最佳投加量。
1.3催化臭氧氧化
催化臭氧氧化技術是在常溫常壓下,將臭氧的強氧化性和催化劑的吸附、催化特性結合,有效提高臭氧利用率和有機物礦化度的AOPs。按催化方式,催化臭氧氧化分為均相催化氧化和非均相催化氧化,其中均相催化氧化以過渡金屬離子為催化劑,引發臭氧產生·OH;非均相催化氧化利用固態金屬、金屬氧化物等固體催化劑的吸附、活化或兩者的協同作用。
水處理過程中,MnO2、NiO和CuO等催化劑主要致力于有機物的高效去除,忽略了副產物溴酸鹽的生成控制問題。因此,一些既能高效礦化水中有機物又能明顯抑制溴酸鹽生成的催化劑成為近年來研究的重點。黃鑫等制備還原態氧化石墨烯(RGO)對其催化臭氧氧化降解草酸及抑制溴酸鹽生成的效果進行研究,結果表明,相比單獨臭氧氧化,RGO/臭氧能將草酸降解率提高10%,并有效抑制了溴酸鹽的生成,溴酸鹽生成量隨著RGO投加量的增加而減少,當RGO投加50 mg/L時,溴酸鹽抑制率可達90%。Nie等發現催化臭氧化過程中β-FeOOH/Al2O3對溴酸鹽的形成有顯著的抑制作用。欒國慶等進行了3種不同載體負載鐵氧化物后在催化臭氧化過程中控制溴酸鹽生成的對比試驗,發現相比載體活性炭和硅藻土,鐵基復合氧化鋁小球穩定性較好,具有催化還原溴酸鹽的能力,對水中溶解性有機物的礦化效率能達到30%左右。
綜上,催化臭氧氧化應用于水處理兼顧有機污染物和BrO3-的控制時,催化劑種類、投加量及Br-濃度等是臭氧催化氧化控制溴酸鹽生成過程中的影響因素,需要通過大量的試驗實現控制。
1.4UV/臭氧
UV/臭氧是以臭氧為氧化劑,通過紫外照射產生·OH間接氧化降解污染物為主的AOPs,在去除有機物方面具有明顯的優越性,其有機物降解效能優于單獨臭氧或UV時的處理效果。Lamsal等研究了臭氧/UV工藝去除天然有機物和降低水源水消毒副產物生成勢,發現臭氧/UV工藝比單獨臭氧、UV工藝能去除更多的TOC和UV254,有效減少較高分子量的NOM,將三鹵甲烷和鹵乙酸的生成勢分別減少了75%和52%。
由于UV照射能將BrO3-轉化為BrO2-然后轉化為HOBr,最后轉化為Br-,在一定程度上可以減少溴酸鹽的濃度,其在臭氧化中對溴酸鹽的作用也受到研究者的關注。薛智新等將臭氧與UV聯用處理含溴水,發現單獨UV輻射含溴水反應30 min內未產生溴酸鹽,臭氧/UV體系產生的溴酸鹽比單獨臭氧少70%左右,處理自然水體時,臭氧/UV產生的溴酸鹽也有所減少。Zhao等進行了臭氧與UV/臭氧工藝同時去除腐植酸(HA)和控制溴酸鹽的對比研究,發現僅當HA濃度達到一定閾值時,UV/臭氧工藝中形成的溴酸鹽低于單獨臭氧過程中形成的溴酸鹽;然而,高劑量臭氧應用于低濃度HA,特別是含高濃度Br-的水時,UV/臭氧工藝中的溴酸鹽仍會超過限值(10μg/L),減少臭氧投加量是UV/臭氧工藝中有效控制溴酸鹽生成和去除HA的一種方法。
1.5UV/H2O2
UV/H2O2作為一種光化學氧化技術,其氧化能力強,不產生二次污染,從UV、H2O2、·OH這3個途徑對大部分有機物進行去除,具有較大的發展潛力。夏萍等研究發現,UV/H2O2對阿特拉津、臭味物質Geosmine、2-MIB的去除率分別達60%、90%、50%以上,且由于H2O2大大過量,HOBr與HO2-迅速反應生成Br-的途徑遠超過HOBr被·OH氧化的途徑,該體系氧化含溴水過程中無溴酸鹽生成。
此外,UV也常與TiO2等催化劑以光催化氧化形式降解污染物,該體系產生的強還原性e-能將BrO3-還原成Br-,而空穴及·OH又可將Br-氧化成溴酸鹽,但后者的氧化速度比前者還原速度慢,因此,該體系表現為溴酸鹽被TiO2催化光解。早在1996年,Andrew等利用Pt改性TiO2光催化還原溴酸鹽,結果表明反應速率是UV/TiO2的4.2倍,去除溴酸鹽效果較好。Huang等采用水熱法制備了TiO2-石墨烯復合材料(P25-GR)光催化還原溴酸鹽,發現在BrO3-質量濃度為10 mg/L、pH值為6.8、催化劑投加量為0.1 g/L時,UV/P25-GR-1%與UV/P25對溴酸鹽的去除效率分別達99%和70%。
當光催化耦合臭氧化時,Parrino等研究表明該氧化體系提高了有機物的氧化速率,并有效控制了溴酸鹽的積累。pH是溴酸鹽還原過程中的關鍵參數,當pH低于光催化劑的零點電荷時,BrO3-與TiO2正電荷表面的相互作用增強,促進了溴酸鹽的還原。
光催化氧化技術作為一種環境友好型的綠色技術,直接利用太陽光催化-臭氧耦合是未來研究的一個方向。
02基于SO4·-的AOPs
近年來,基于SO4·-的新型AOPs在處理水和廢水中有機物和進行土壤修復方面引起了廣泛關注,逐漸成為可以替代傳統AOPs的深度處理工藝。SO4·-具有與·OH相近的氧化還原電位(E0=2.5~3.1 V),可以氧化降解多種有機污染物。SO4·-可以通過活化過硫酸氫鹽或過二硫酸鹽產生,其活化方式包括加熱、紫外光輻射、過渡金屬活化、堿活化、活性炭活化等。此外,過硫酸鹽多為固態,具有高水溶性和相對穩定性,但是其應用過程中可能產生的有毒有害物質(如溴酸鹽)仍然不能被忽視。
2.1UV/過硫酸鹽
在UV照射下,過硫酸鹽分解為SO4·-且UV應用較為廣泛的波長為254 nm。Fang等采用UV/PDS在超純水中降解二溴代乙酰胺,發現溴原子向溴酸鹽轉化率高達100%,隨后進一步對UV/PDS處理含溴水過程中溴酸鹽的生成規律進行了研究。結果表明,增加PDS劑量或Br-摩爾濃度(0.5~5.0μmol/L)會生成更多的溴酸鹽,堿性條件下形成的溴酸鹽量比中性和酸性條件降低90%以上,而溶液中天然有機物(NOM,0~1.0 mg/L)也會顯著抑制溴酸鹽的生成。該研究提出了Br-與SO4·-反應生成溴酸鹽的主要途徑,包括中間體HOBr/OBr-和最終產物BrO3-的形成,具體反應如式(1)~(3)。

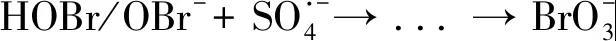
Liu等研究了溶解性有機物在UV/PDS/Br-體系中抑制溴酸鹽形成機理,發現在相同條件下,模型化合物抑制作用為1-酪氨酸>苯酚>叔丁醇>檸檬酸>甲醇>草酸,與其完全礦化所需的氧化劑量相一致,表明它們的羧酸、醛、醇和酮等氧化中間體在反應中持續清除活性自由基。Wang等在Br-、鄰苯二甲酸二乙酯(DEP)或NOM共存時進行了UV/PDS降解的試驗研究,結果表明Br-顯著抑制了DEP的降解,且該體系中生成了三溴甲烷(TBM)與BrO3-進一步探究發現,增加PDS劑量和初始Br-濃度會增加TBM的最大濃度并促進BrO3-的形成,而增加DEP和NOM的量會促進前者并抑制后者,隨著pH值從5.0增加到8.0,TBM的最大濃度也隨之增加,而BrO3-的形成受到抑制。
值得注意的是,在UV/過硫酸鹽技術實際應用中,有機物種類繁多且普遍對UV具有吸收作用,限制了UV穿透并活化過硫酸鹽,進而影響UV/過硫酸鹽技術的處理效率。
2.2臭氧/過硫酸鹽
Yang等提出并證實了臭氧活化PMS能同時產生·OH和SO4·-并對比研究了臭氧分別與PMS、PDS、H2O2聯用降解莠去津和硝基苯的動力學,發現臭氧/PMS體系對目標物有很好的降解效果。劉占孟等采用臭氧耦合PDS預處理制藥廢水,發現在兩者的協同作用下,CODCr、色度的去除率分別可達68.3%、97%,可生化性也有所提高。在臭氧/過硫酸鹽體系中加入催化劑促進過硫酸鹽的活化來提高有機物的降解效率也被廣泛關注。Nematollah等研究發現,將磁性銅鐵氧體納米顆粒(CuFe2O4)加入臭氧/PMS體系對2,4-二氯苯氧乙酸降解程度較高。
然而,關于臭氧/過硫酸鹽技術氧化過程中生成溴酸鹽的研究較少。Wen等探究了臭氧/PMS氧化過程中影響溴酸鹽生成的因素,結果表明,與單獨臭氧相比,臭氧/PMS體系顯著促進了溴酸鹽的形成,溴酸鹽的生成量隨PMS劑量、pH、Br-初始摩爾濃度(2.0~10.0μmol/L)的增加而增加。而實際水樣中的NOM、碳酸氫鹽、氨的存在使溴酸鹽的轉化受到明顯抑制。強晨在臭氧/PMS體系中添加碳基催化劑,不僅增強了對有機物的降解效果,而且抑制了溴酸鹽的生成,該研究還表明pH、催化劑種類及投加量是抑制溴酸鹽生成的因素。
臭氧/PMS工藝對微污染物的氧化去除效率相對較高,但臭氧、·OH和SO4·-的綜合效使溴酸鹽生成顯著,因此,將臭氧/PMS技術應用于含Br-水體的有機物去除時應評估溴酸鹽的形成。
2.3鈷/過硫酸鹽
過渡金屬離子活化無需外加熱源和光源,在常溫條件下即可實現。研究表明,在均相過渡金屬活化中,鈷離子(Co2+)對PMS表現出最佳的活化性能。
Li等研究了鈷催化PMS體系中溴酸鹽生成的情況,結果表明,增加PMS或Co(II)的劑量會增加溴酸鹽的生成,但為實現相同水平的微污染物降解并控制溴酸鹽的形成,增加PMS劑量優于增加Co(II)劑量。向該體系中添加甲醇抑制了溴酸鹽的生成,但生成的游離溴隨Co(II)劑量的增加而增加,而同時添加甲醇和Co(III)螯合劑(乙二胺四乙酸二鈉,EDTA)時,Co(III)被EDTA穩定形成了無法氧化溴化物的CoIIIEDTA-絡合物,所以未檢測到游離溴或溴酸鹽。
加Cl2/NH4+等是臭氧氧化過程中抑制BrO3-生成的方法,其在過硫酸鹽體系的作用也得到研究。Ling等探究了NH3、Cl2-NH3、NH3-Cl2預處理方法對Co(II)/PMS工藝中溴酸鹽形成的影響,結果表明,在pH值為4、反應20 min時,分別投加20、50、200μmol/L的NH3,BrO3-抑制率分別為2.6%、9.5%、75%;對于Cl2-NH3和NH3-Cl2,添加15μmol/L的HOCl和50μmol/L的NH3可使整體BrO3-的形成減少95%以上,并延遲BrO3-的形成。但考慮到水中的氮含量超標可能會引起問題,添加200μmol/L的NH3(相當于2.8 mg/L的N)來控制過程中BrO3-的形成不可行。
2.4熱/過硫酸鹽
熱活化過硫酸鹽技術是以加熱的方式使過硫酸鹽中的O-O鍵斷裂生成SO4·-該氧化技術對多種有機物有較好的降解效果。Huang等通過熱活化過硫酸鹽有效降解了59種揮發性有機物。然而,溫度升高也會加速其他反應,如·OH或SO4·-的重組,從而降低目標污染物的去除效率。另外,溫度升高對飲用水處理過程中溴酸鹽的生成具有促進作用。
Lu等在腐植酸、Br-存在下研究了熱活化PDS氧化工藝中溴化物的轉化情況,發現該氧化過程生成了溴代消毒副產物(Br-DBPs),其中溴仿和二溴乙酸為主要的Br-DBPs,體系中過量的SO4·-也會使Br-DBPs進一步降解,最終將Br-轉化為BrO3-提出的轉化方案如圖2所示。Huang等證實了在熱活化PMS過程中RGO與HOBr反應生成Br-而抑制BrO3-的作用,研究表明pH值為7、活化溫度為80℃、添加RGO劑量為5~35 mg/L時,BrO3-的生成量降低約67%~100%,且在pH值為5~9和活化溫度60~80℃時添加RGO均可顯著降低BrO3-的生成量。
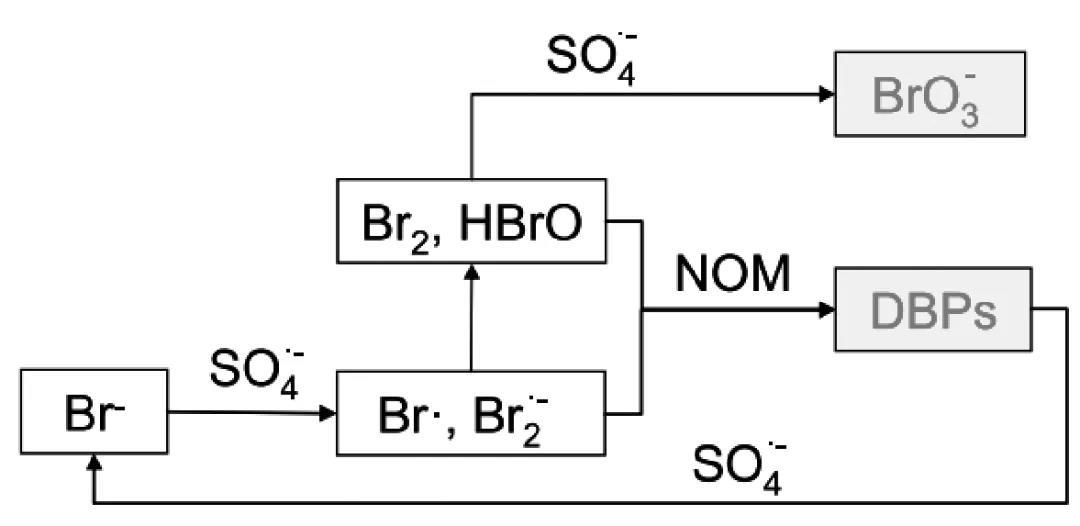
Br-DBPs具有“三致”(致癌、致畸和致突變)作用,因此,應用過硫酸鹽氧化技術時Br-DBPs的生成問題不容忽視,且加熱活化過硫酸鹽對能量輸入的要求很高,不適合大規模應用于飲用水處理,但因其在高溫廢水的處理方面不需要增加外能而具有廣闊的發展前景。
03結論與展望
基于·OH或SO4·-的AOPs不僅能有效去除難降解有機物,還可以實現對新興污染物和消毒副產物的控制,在水處理方面具有較好的應用前景。而溴酸鹽問題已成為臭氧化技術、過硫酸鹽氧化技術大規模應用于飲用水處理的限制因素之一。H2O2、UV、催化劑與臭氧的聯用技術在保證高效降解有機污染物的同時,能夠控制副產物BrO3-的生成,UV/TiO2技術也對溴酸鹽具有較好的去除效果。向過硫酸鹽氧化體系添加Cl2-NH3、催化劑、自由基清除劑等對溴酸鹽的產生也有抑制作用,此外,過硫酸鹽氧化體系中可能產生除溴酸鹽之外的Br-DBPs。
因此,今后AOPs處理含溴水的發展方向主要集中在以下方面:開發既能有效降解有機物又能控制溴酸鹽的高效無污染的氧化劑,注重AOPs的聯用;深化研究后續去除已生成溴酸鹽的技術,如活性炭吸附法、生物法等;進一步探討控制溴酸鹽方面仍然存在爭議或不明確的機理與因素;關注體系中其他副產物的產生情況;改善操作條件,提高反應效率,尋求更大的適用性與經濟性,提高在工程上的應用的可能性。
















